国产甲流疫苗进入临床试验期
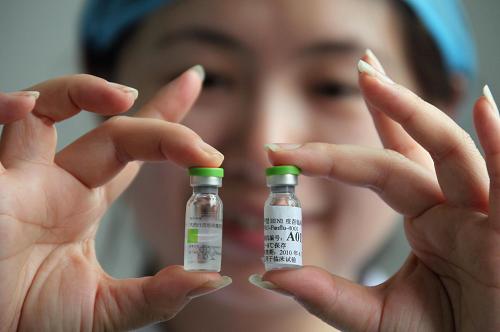
经济观察网 记者 汪言安 经济观察网记者获悉,昨天(7月22日)早上6点,由北京科兴生物制品有限公司生产的甲型H1N1流感疫苗在北京正式开始临床试验,几个小时后,另一家疫苗研制企业华兰生物(002007)也以公告的形式宣布“研制的甲型H1N1流感疫苗在江苏省泰州市开展临床观察,正式进入临床验证阶段。”
6月8日,北京科兴生物正式获得由美国CDC提供的甲型H1N1流感疫苗生产用毒株NYMC X-179A,当晚立即启动了种子批制备工作。在6月初,国内相继有多家疫苗生产企业获得了甲流感毒株。
北京科兴生物从6月15日正式开始第一批疫苗的生产。7月3日第一批疫苗正式送中国药品生物制品检定所检定。截至7月21日,共计有8批疫苗获得检定合格证书。
据北京科兴生物透露,国家食品药品监督管理局对本次临床试验高度重视,为此专门派出专家组亲临现场视察。临床试验则由北京疾病预防控制中心负责实施,由疾控部门来选择临床受试志愿者。
据了解,本次试验共需受试志愿者1600名,接种程序为60岁以上老年组接种1针;3岁至60岁的成人、少年和儿童组需要接种2针。预计,本周所有受试者完成第一针接种,8月中旬开始第二针接种,9月中旬完成全部临床研究。试验疫苗共分3种类型:加佐剂灭活疫苗(5微克、10微克)、加佐剂裂解疫苗(7.5微克、15微克)、无佐剂裂解疫苗(15微克、30微克)。
此次华兰生物的临床验证研究将在泰州招募2000多名志愿者参与,分批于7月22日、7月24日和7月25日接种。接种分为五个年龄组,免疫程序为0天、21天各接种1次,于0天、21天、35天、42天采血检验测定抗体滴度,并建立志愿者“一人一档”,对志愿者的跟踪回访将一直进行至6个月后。
根据这一临床试验周期,从试验开始到验证其安全性、有效性,再到确定其免疫程序和免疫剂量,直至疫苗正式生产出来,仍需时日,“不出意外的话,9月中旬或能正式投入生产。”华兰生物一不愿具名的高管透露。
此前,记者从多个渠道采访证实,根据中国目前制定的甲型H1N1流感防控策略,甲型H1N1流感疫苗研制成功后不会上市销售,“主要将用于国家储备,以应对今年秋冬季节可能出现的流感疫情。”
据卫生部最新通报,7 月20日18时至7月22日18时,中国内地新增甲型H1N1流感确诊病例104例,其中58例为境外输入性病例,46例为境内感染病例。截止目前,中国内地累计报告1772例甲型H1N1流感确诊病例,已治愈1454例,没有因甲型H1N1流感所致的重症病例和死亡病例。
- · 香港发现甲流病毒变异病例 | 2009-11-24
- · 甲流病例53例死亡 1634.9万人接种甲流疫苗 | 2009-11-17
- · 中国发现2例接种甲流疫苗后死亡病例 | 2009-11-13
- · 先声药业增持江苏延申 下注甲流疫苗 | 2009-11-12
- · 四川出现省内首例甲流死亡病例 | 2009-11-06







 聚友网
聚友网 开心网
开心网 人人网
人人网 新浪微博网
新浪微博网 豆瓣网
豆瓣网