
(图片来源:全景图片)
经济观察网 记者 温淑萍 “现在,仍有21种罕见病在我国面临 ‘境外有药、境内无药’的困境。这是无法以一己之力打破的高墙。” 2月28日 ,国际罕见病日,罕见病发展中心主任兼创始人、全球委员会成员黄如方接受记者采访时称,中国有预计超过2000万罕见病患者,每年新出生的罕见病患儿超过20万,但药物可及性也成为第一个重要问题。
据了解,全球有7000多种罕见病。在罕见病的病人圈内一个共同的认知,有药可治的罕见病是一种幸运。
而疾病有治疗药物却尚未在国内上市,则又给对患者健康和生存希望带来失落。
境内无药
据消除罕见病患儿诊断壁垒全球委员会发布的2019年中国罕见病报告显示,在中国无药物的21种罕见病分别如下:

全球领先的罕见病药物生产巨头,在中国上市的罕见病药品数量少之又少,关于中国21种罕见病无药可用的原因,黄如方透露,主要是罕见病药物的上市面临诸多阻碍,且制药企业在面临“不确定”的市场情况时通常选择沉默。
就罕见病这一群体来看,患者群相比如肺癌等症的患者群要小的非常多,这使得企业有“收益不确定”的担忧。因此,企业通常缺乏研发、仿制及生产罕见病药物的动机。
其次,企业还面临来自注册准入环节的“成本不确定”。黄如方介绍,药物在我国上市意味着要投入资源进行临床试验并准备药品的安全与疗效证据。在患者数量有限的情况下,企业会预期药品销售难以收回注册成本,因此即使国外上市了药物,但会选择不进入中国市场。
此外,部分药品还面临“监管不确定”的阻碍。如血液制品就面临特殊的海关进口管制,企业在进入中国市场时也必须谨慎考量。
最后,还有来自医保准入环节的“支付不确定”。罕见病药物的研发和生产成本相对偏高,企业在患者群体较小的情况下倾向于制定较高的价格。如果我国没有明确的罕见病药物医疗保障政策,那么能够支付得起药品治疗费用的患者数量将更加有限。而对于“高值药品”,尤其是治疗费用高昂到患者几乎没有自费可能的罕见病药物,企业在国内的进入选择上还面临道德拷问和伦理困境。在药品销售预期无法负担前期研发及生产成本时,企业选择不进入中国市场。
而包括瑞颂、诺华、百傲万里、武田、杰特贝林等企业研发的罕见病药物数量都相对较多,但中国与美国市场的上市差距却非常大,详见下图:

力图打破不确定
事实上,对于中国罕见病药物的短缺,自 2015 年以来,主管部门出台了多项政策措施,力图打破笼罩在罕见病药物上的“市场不确定”,鼓励罕见病药物的引进、研发和生产,并加快罕见病药品的注册审评审批。
2015 年 8 月,国务院印发《关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44 号), 2017 年 10 月中共中央办公厅、国务院办公厅印发《关于深化审评审批制度改革鼓励药品医疗 器械创新的意见》(厅字〔2017〕42 号),对鼓励罕见病用药研发、加快罕见病药品注册审批 提出明确意见。
2016 年 2 月,原国家食品药品监督管理总局发布《关于解决药品注册申请积压实行优先审评审 批的意见》(食药监药化管〔2016〕19 号)并于 2017 年 12 月进行了修订,明确对治疗罕见 病的药品注册申请予以优先审评审批,并允许在申报临床试验时即可提出减少临床试验病例数或免做临床试验的申请。
2018 年 4 月 25 日,国家药品监督管理局组织起草了《药品试验数据保护实施办法(暂行)(征 求意见稿)》,并向社会公开征求意见。在征求意见稿中,将罕见病治疗药品列为数据保护对象, 自该适应症首次在中国获批之日起给予 6 年数据保护期。据悉该办法将根据征求意见情况进一 步修改完善后发布。
2018 年 5 月,药品监督管理局与国家卫生健康委员会联合发布《关于优化药品注册审评审 批有关事宜的公告》(2018 年第 23 号),进一步明确国家药品监督管理局药品审评中心对罕 见病药品研发的指导;对于境外已上市的罕见病药品,进口药品注册申请人经研究认为不存在人种差异的,可以提交境外临床试验数据直接申报药品上市注册申请。截止 2018 年 12 月底, 有 13 种罕见病药品通过优先审评审批申请上市,涉及《第一批罕见病目录》中 10 种罕见病。
2018 年 8 月,国家药品监督管理总局药品审评中心发布《关于征求境外已上市临床急需新药名 单意见的通知》,遴选出 48 个临床急需且已经在美国、欧盟或日本上市的药品,经研究后如不存在人种差异即可利用境外研究数据申请上市。有 20 种药物的适应症涉及《第一批罕见病目录》 中的 12 种疾病。
2019 年 2 月 11 日,国务院常务会议指出,“加强癌症、罕见病等重大疾病防治,事关亿万群 众福祉......要保障 2000 多万罕见病患者用药。从 3 月 1 日起,对首批 21 个罕见病药品和 4 个原料药,参照抗癌药对进口环节减按 3% 征收增值税,国内环节可选择按 3% 简易办法计征 增值税。”
下图为2018年优先审评申请上市的《第一批罕见病目录》相关药品:

黄如方认为,缺乏罕见病药物身份认定及独立的罕见病药物注册审评审批通道,仍是一道隐形的罕见病药物可及障碍之墙。此外,罕见病药物在国内的引进、注册和上市,还需要一系列配套政策法规的落地。例如, 我国在 1986 年曾以卫生部的名义对外发布公告,除了人血清白蛋白外,禁止进口血液制品。时至今日, 这一规定依旧影响着血液制品的引进。在《第一批罕见病目录》中仍有部分罕见病依赖于将血液制品 作为其主要预防和治疗方案,在国内生产企业研发和生产罕见病相关血液制品的动机不足的情况下, 缺乏进口无疑封堵了患者对健康和生存的希望。
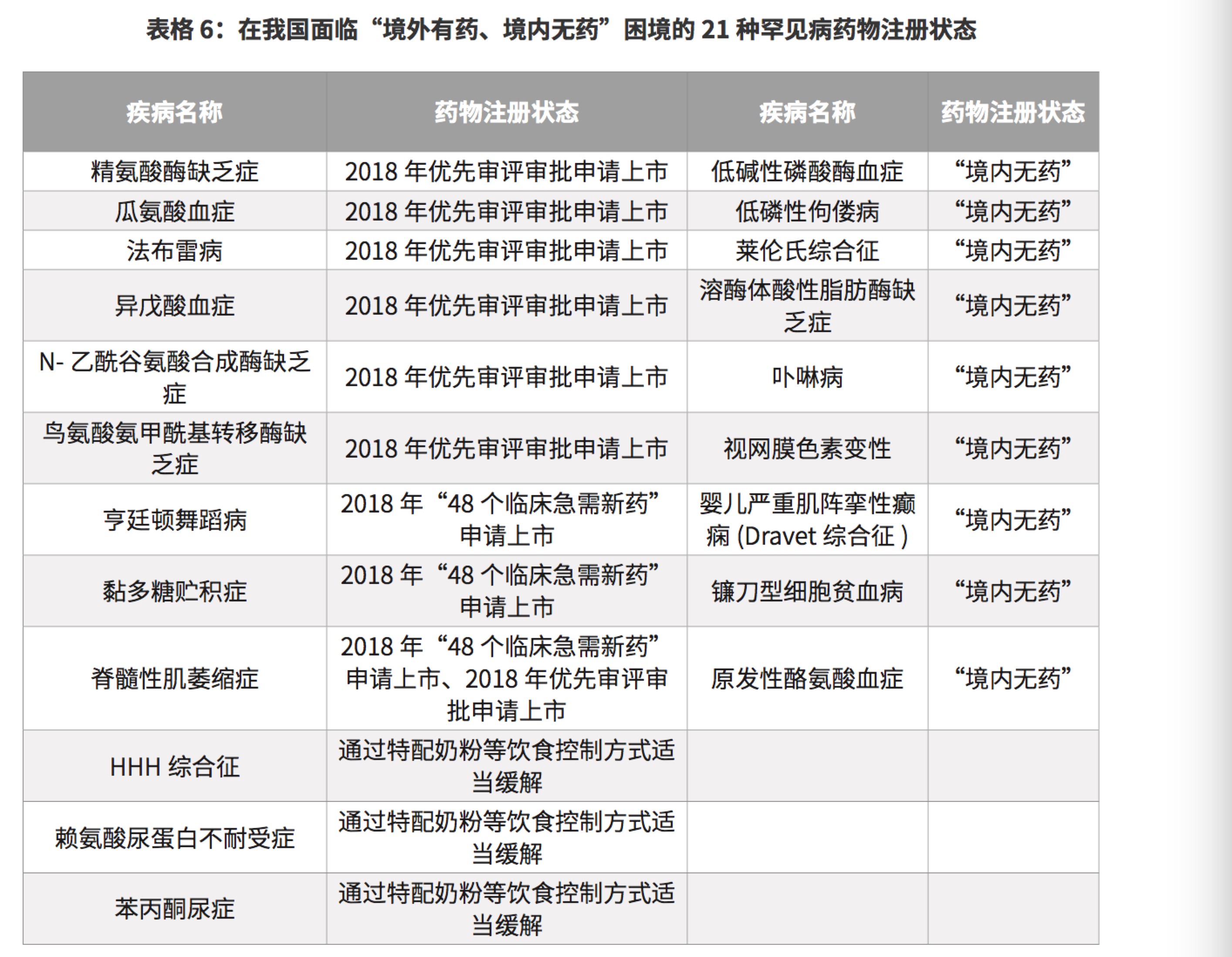
目前中国面临的“境外有药、境内无药”困境的21种罕见病药物注册状态如下:
黄如方称,他作为一名罕见病患者和全球委员会成员,我有义务为那些长期被忽视、处于缺医少药状态的罕见病患者群体发声。
昂贵的生命线
在罕见病群里中,事实上,另一个令这一群体感到失落的问题是,治疗费用昂贵。
以美国为例来看:

而目前中国的情况是,已经上市且有罕见病适应症的 55 种药物中,有 29 种药物被纳入国家医保目录,涉及 18 种罕见病。这 29 种药物中,有 9 种享受国家医保目录甲类报销,用于治疗 11 种罕见病适应症,患者使用时无需自付。
在以往两轮国家医保谈判中都出现了罕见病药物的身影。2017 年国家人力资源与社会保障部通过 谈判将治疗血友病的重组人凝血因子 VIIa,治疗多发性硬化的重组人干扰素 β-1b,和治疗结节性硬化 症的依维莫司纳入国家医保目录乙类报销。2018 年国家医疗保障局通过抗癌药谈判将治疗肢端肥大症 的奥曲肽纳入国家医保目录乙类报销,但肢端肥大症并不在《第一批罕见病目录》中。
黄如方认为,中国政府在解决罕见病药物保障上,已经迈出了积极的步伐。
记者在2019年中国罕见病报告中发现,这 13 种罕见病的药物治疗花费中,年治疗费用高的近 500 万元,低的则仅需 189 元,中位值 为 20 万元。这 13 种罕见病在我国约影响 23 万名患者,大部分人需要终生用药治疗。其中,有 11 种 药物的年治疗费用大于 8 万元人民币,在没有医保支付的情况下,患者难以维持长期足量和足疗程的 治疗。对患者来说,这些药如同“水中的月亮”,可望而不可及。
如下图:

黄如方称,大部分罕见病患者需要终生用药,在药物不可及、不可负担的情况下,难以维持长期足量和足疗程的治疗,因病致残现象较为普遍。
而自 2014 年起至 2018 年 12 月,在罕见病发展中心登记注册的罕见病患者共计 5810 人,其中 42% 的患者(2448 人)没有接受任何治疗,而在 58% 接受治疗的患者中,有绝大部分未能及时且足量地服用治疗药物。
在登记的 5810 名患者中,有一半以上的患者因病致残,其中 29% 的患者为肢体残障,15% 为多重残障(即同时有两种以上残障类型)。在有残障表现的 3174 名患者中,17% 的患者为一级残障, 17% 为二级残障,8% 为三级残障,5% 为四级残障。


京公网安备 11010802028547号