
经济观察网记者 瞿依贤 3月17日,康希诺生物(06185.HK)发布公告称,其与军事科学院军事医学研究院生物工程研究所联合团队合作研发的重组新型冠状病毒疫苗(腺病毒载体)已经获批临床。
3月16日,美国国立卫生研究院和Moderna公司开发的mRNA(信使核糖核酸)疫苗启动临床试验。中美几乎同时启动新冠疫苗临床试验。
全球疫情持续蔓延,截至3月20日,意大利确诊人数超4万,伊朗、西班牙、德国、美国、法国确诊人数也过万,全球已有43个国家进入紧急状态。在没有特效药的情况下,人们把目光投向疫苗,钟南山说“疫苗是解决新冠肺炎最根本的东西,最终形成群体免疫是靠疫苗”。
中国医学科学院医学实验动物研究所研究员秦川表示,在国内,科技攻关组同步部署了5条技术路线进行疫苗研发,目前已有8种疫苗在中国医学科学院进行有效性评价,部分疫苗的有效性评价工作已经完成。
那么,什么是腺病毒载体疫苗、mRNA疫苗?新冠疫苗研发的5种路径分别是什么?目前有哪些公司、机构的研发进度走在前面?预计什么时候新冠疫苗可以上市?
几种研发路径
中国工程院院士王军志在3月17日的国务院联防联控机制新闻发布会上公布了国内新冠疫苗研发的详细情况:新冠疫苗研发分为灭活疫苗、基因工程重组亚单位疫苗、腺病毒载体疫苗、减毒流感病毒载体疫苗和核酸疫苗五条技术方向。
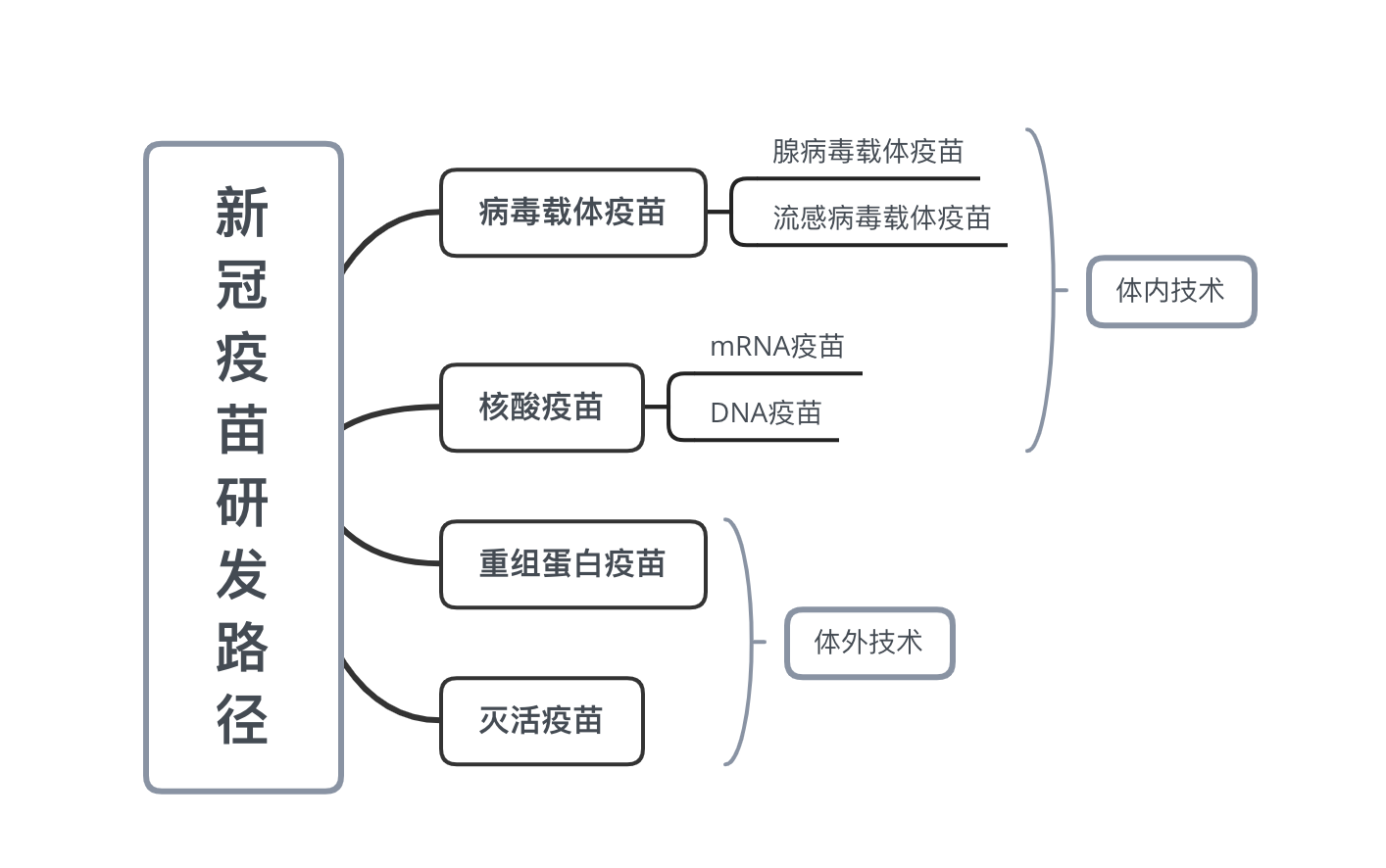
疫苗专家陶黎纳告诉经济观察网,腺病毒载体疫苗和流感病毒载体疫苗都是病毒载体疫苗,核酸疫苗分为mRNA疫苗和DNA疫苗。
陶黎纳表示,灭活疫苗是把病毒直接杀死后做成疫苗,成分比较复杂,可能含有不能导致产生免疫的成分,还可能带来不良反应。从生物技术的角度说,灭活疫苗比较简单,问题在于生产过程可能会有风险,因为它生产的是活病毒,万一有泄漏,安全性也会有问题;另外灭活疫苗产量也可能有问题,因为培养病毒可能没那么快。
“从体内和体外两类来看:灭活疫苗和重组蛋白疫苗是体外技术,病毒载体疫苗和核酸疫苗是体内技术。”陶黎纳说,重组蛋白疫苗相当于把病毒的S蛋白基因整合到酵母菌、大肠杆菌等微生物里面,然后在体外大量培养,表达出病毒的S蛋白,再收获、提纯S蛋白,最后做成疫苗,“给人直接打S蛋白”。
病毒载体疫苗和核酸疫苗都需要把病毒的S蛋白基因提取出来,腺病毒载体是把基因嵌入到腺病毒里面,然后把腺病毒打到人体内,这个腺病毒本身不会致病,并且它携带的病毒S蛋白可以在体内合成S蛋白,相当于在体内生成疫苗;核酸疫苗是把S蛋白基因相单独拿出来打到人体内,不需要嵌合到病毒基因里面,也是在人体内合成蛋白。
陶黎纳说,体内技术和体外技术的区别在于,体内技术只要有病毒的蛋白基因就行,“基因很简单,就是四种核苷酸的排列,只要有排列顺序,放在哪都能生产出来”,所以体内技术疫苗的生产很简单,产能也很高,“问题在于让人体去生产目标疫苗成分,但是它进入人体的机制还不清晰”。
根据国内对疫苗产品的审批要求,在研疫苗产品需完成临床前研究、临床试验批准、临床I期、II期和/或III期试验、上市批准、生产设施认证/核查(如适用)等主要环节。而疫苗进入临床试验必须完成药学方面研究、有效性研究和安全性研究。
王军志介绍,药学方面研究主要包括菌毒种和细胞库建立、工艺研究和质量标准研究等,要建立稳定的生产工艺和质量控制标准,以保证制备出合格的疫苗样品;有效性研究是在获得疫苗样品后,采用感染动物模型(比如新冠病毒的猴感染模型和鼠感染模型)来评价疫苗免疫原性和保护效果,这个结果可用来推算临床研究的剂量和程序;疫苗安全性评价是针对新发传染病至少要进行动物单次给药(急性)毒性和重复性给药(长期毒性)评价。
“总的来说,首先要生产出合格疫苗样品,在动物实验中证明安全有效性后,才能进入临床试验。”王军志说。
研发竞赛
3月16日,美国生物技术公司Moderna公司的mRNA(信使核糖核酸)新冠病毒疫苗mRNA-1273在美国启动1期临床试验,并且首位参加临床试验的志愿者已经完成疫苗接种。据了解,这项临床试验将招募45位志愿者。
同一天,德国生物技术公司BioNTech也披露了自己的疫苗研发进展。BioNTech研发的疫苗也是一款mRNA疫苗,在获得监管部门批准后,该公司计划在4月下旬启动包括欧洲、美国和中国在内的全球性临床开发项目。
经济观察网不完全统计,国内目前正在研发新冠疫苗的企业除了康希诺生物,还有智飞生物(300122.SZ)、冠昊生物(300238.SZ)、康泰生物(300601.SZ)、成大生物、武汉博沃生物、斯微生物、北京科兴生物等公司。
3月14日,复星医药(600196.SH)公告称,其控股子公司上海复星医药产业发展有限公司(下称“复星医药产业”)获BioNTech SE许可在中国独家开发和商业化基于其专有的mRNA技术平台研发的针对COVID-19的疫苗产品。
根据协议,复星医药产业将根据约定向BioNTech支付至多8500万美元的许可费(包括首付款、临床开发注册及销售里程碑款项),并在约定的销售提成期间内按该产品年度毛利的35%支付销售提成。
复星医药在公告中表示,该产品在德国处于临床前研究阶段,尚未在中国开展临床研究相关工作。因此,按预防性疫苗的常规临床试验及注册流程,预计该产品短期内不会在中国上市。
从已经公开的进度来看,康希诺生物与军事科学院军事医学研究院陈薇院士合作的腺病毒载体疫苗、美国Moderna公司的mRNA疫苗和德国BioNTech公司的mRNA疫苗是进度较快的几款疫苗。

在陶黎纳看来,mRNA疫苗领域目前还没有任何一款人用疫苗上市,但是Moderna之前针对其他病毒做过mRNA疫苗,人体试验做过大约1000例,这次之所以比较快进入临床是跳过了动物试验。国内康希诺生物的优势在于,腺病毒载体疫苗在埃博拉疫苗的开发上已经成功,康希诺生物的埃博拉疫苗已经获得批准,只是没有在民用领域使用,“腺病毒载体疫苗应该比mRNA疫苗更成熟”。
传统来说,一个疫苗的临床研究需要2-3年时间,但陶黎纳认为,疫情当前,军事科学院的腺病毒载体疫苗最快只需要1-2个月完成主要观察目标,“现在的疫苗成分都很精确,不存在未知成分,有什么大致效果都是有估计的,安全性我不是太担心”。
目前有些省份已经“清零”,没有现存确诊新冠肺炎病例,疫情在好转,这是否对验证疫苗有效性有影响?
“有很大影响,最终的有效性可能没有办法在国内得到验证。我们可以观察到打了疫苗以后,有多少人的抗体阳转、抗体的平均水平是多少,但是不知道抗体到底能不能保护健康人群。我们可以说,达到95%或者更高的阳性值可以起保护作用,但是这不是必然划等号的。”陶黎纳表示,验证疫苗的有效性可以通过国际合作进行。


京公网安备 11010802028547号